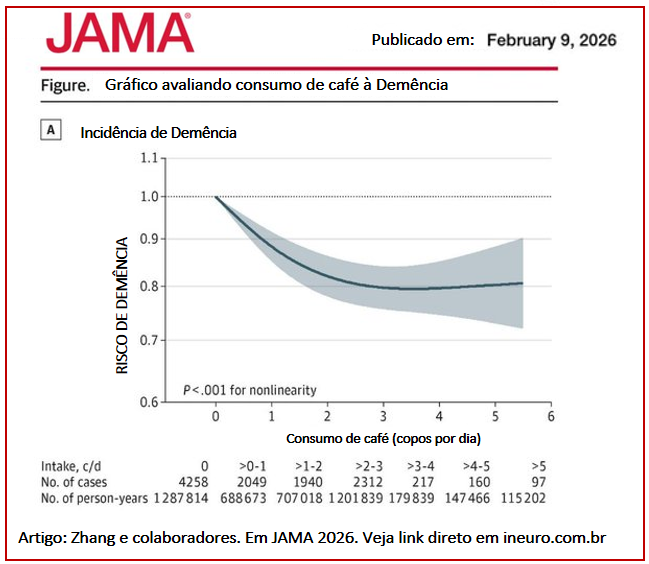
O mundo dá voltas.
A ciência… Também.

Os mesmos pesquisadores neurologistas, neurointervencionistas e cirurgiões vasculares que enterraram a angioplastia carotídea em doença da carótida cervical, no primeiro CREST, 15 anos atrás, favorecendo a endarterectomia para a maioria dos casos de atero carotídea, conseguiram operacionalizar um estudo super difícil de se fazer, que durou longos 11 anos para ser finalmente terminado, apresentado e publicado com grande alarde, na última semana, durante o congresso da SVNI, em Orlando, EUA, com publicação simultânea na NEJM.
O CREST-2 conseguiu incluir 2400 pacientes com aterosclerose carotídea assintomática, comparando tratamento médico versus revascularizar as estenoses de carótidas nos casos sem AVCi ou AIT no território da artéria estenosada há pelo menos 6 meses.
Estudo: financiamento pelo NIH (National Institute of Health americano). Nada de indústria na jogada… 155 centros americanos, no Canadá, Austrália e Israel.
Critérios para entrar no trial: >35 anos, presença de estenose carotídea assintomática com >70% de estenose (critérios por CTA ou MRA ou US carótidas).
Dois Braços de tratamento – braço de stenting e de endarterectomia: 4 grupos ativos de tratamento – TMI (tratamento médico intensivo) sozinho vs TMI + angioplastia (CAS), e outro com TMI + endarterectomia (CEA) vs TMI sozinho.
Desfecho primário: qualquer AVC ou morte nos primeiros 44 dias (período perioprocedimento), e em follow-up de 4 anos associando-se o evento de AVC ipsilateral isquêmico até 4 anos (pós-período periprocedimento).
Resultados
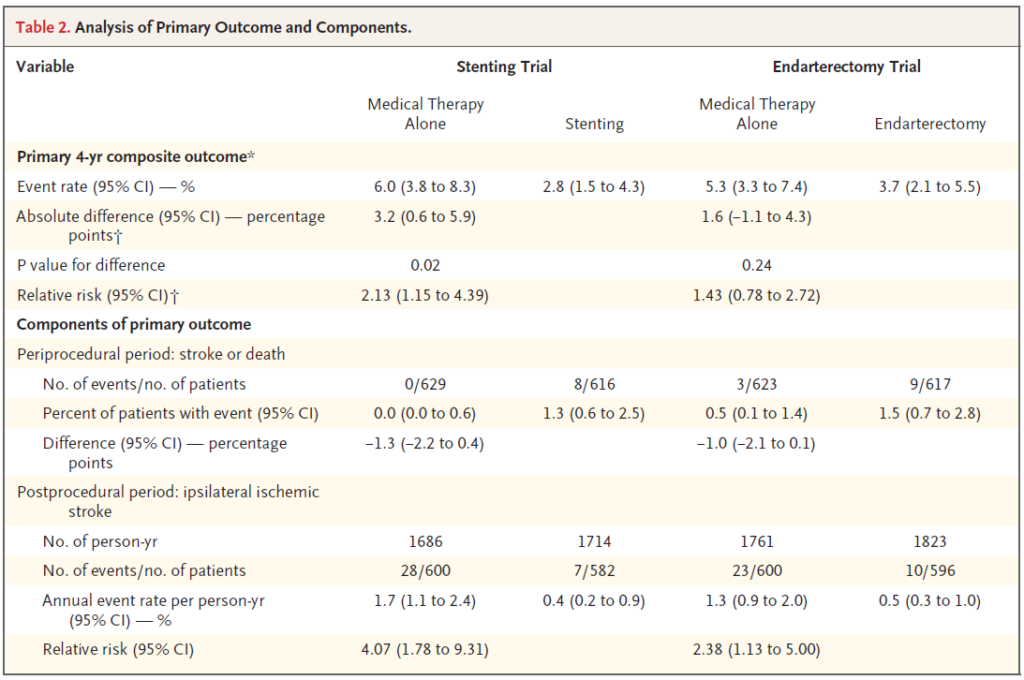
No braço de CEA, o desfecho primário foi menor no grupo CEA, mas sem significância estatística –> 3.7% vs 5.3% com p =0.24%. O RR de ter evento foi de 1,43 x maior nos pctes tratados clínicamente (95% CI 0.78-2.72).
Nos primeiros 44d após a randomização, houve 3 AVCs nos casos tratados clinicamente, e 9 AVCs e uma morte nos submetidos a CEA. Após o dia 44, no grupo médico houve 23 AVCi ipsilateral (1,3% de taxa anual de evento (95%CI, 0.9-2,0), e no grupo CES, 10 AVCi ipsilaterais (taxa anual de 0,5% [95%|CI 0,3-1.0), pontuando um RR de 2.38.
No braço do stent (CAS), o desfecho primário foi de 6% no grupo clínico e 2,8% no grupo CAS, com RR absoluto menor em 3,2% favorável à CAS, p=0,02. O RR de ter evento foi de 2,13 x maior nos pctes tratados clínicamente (95% CI 1.15-4.39).
Nos primeiros 44d após a randomização, houve zero AVC ou morte nos tratados clinicamente, e 7 AVCs e uma morte nos submetidos a CAS. Após o dia 44, no grupo médico houve 28 AVCi ipsilateral (1,7% de taxa anual de evento (95%CI, 1,1-2,4), e no grupo CAS, 7 AVCi ipsilaterais (taxa anual de 0,4% [95%|CI 0,2-0,9), pontuando um RR de 4,07.
Tabeilinha dos desfechos. Vejam…
LINKS
Brott et al. Medical Management and Revascularization for Asymptomatic Carotid Stenosis. NEJM 2025.
Brown & Bonati. Managing Asymptomatic Carotid Stenosis. Editorial. NEJM 2025.